キーワード: アルツハイマー病、パーキンソン病、多系統委縮症、筋萎縮性側索硬化症、前頭側頭葉性変性症
http://www.md.tsukuba.ac.jp/clinical-med/neurology/index.html
 神経変性疾患はアルツハイマー病、パーキンソン病、多系統委縮症、筋萎縮性側索硬化症、前頭側頭葉性認知症などを含む難治性疾患です。神経細胞が原因不明のままに脱落していくこれらの疾患は老化とも関連が深い。リサーチユニット「神経分子病態解析学」は、特に神経変性疾患の神経系に異常蓄積するタンパク質の分子病態に焦点を絞って、病因関連物質の解析を推進するとともに、神経変性疾患の治療法の開発に向けた研究に力をいれています(図1)。
神経変性疾患はアルツハイマー病、パーキンソン病、多系統委縮症、筋萎縮性側索硬化症、前頭側頭葉性認知症などを含む難治性疾患です。神経細胞が原因不明のままに脱落していくこれらの疾患は老化とも関連が深い。リサーチユニット「神経分子病態解析学」は、特に神経変性疾患の神経系に異常蓄積するタンパク質の分子病態に焦点を絞って、病因関連物質の解析を推進するとともに、神経変性疾患の治療法の開発に向けた研究に力をいれています(図1)。
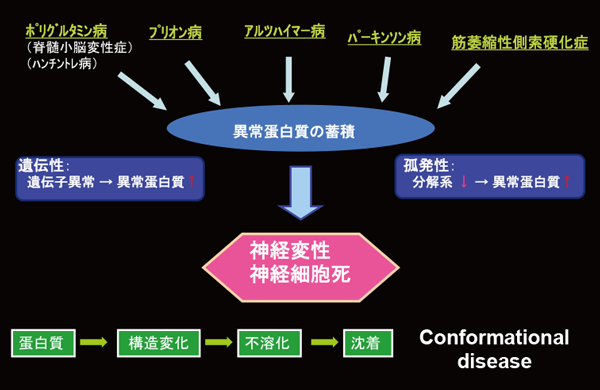
図1:神経変性疾患の分子病態
アミロイド・カスケード仮説を支持する重要な根拠
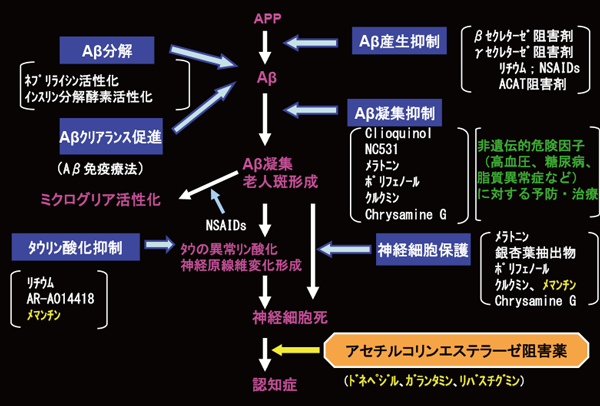
図2:アミロイドカスケード仮説とそれに基づくアルツハイマー病治療戦略
ポリグルタミン病、プリオン病、アルツハイマー病、パーキンソン病、筋萎縮性側索硬化症(ALS)などは、原因不明のまま神経細胞が脱落していく疾患ですが、どの疾患でも共通して観察されるのは神経系への異常タンパク質の沈着です。沈着は、タンパク質の構造異常や、タンパク質分解系の障害などにより生じていることが明らかにされてきていることから、異常タンパク質の沈着に焦点を絞った研究が世界中で行われています。そのなかで私たちが注目しているのがアミロイドβ蛋白(A β)です。A βは日本で約400 万人の患者がいるアルツハイマー病の発症において、最も初期に沈着が観察されるタンパク質です。A βに注目した先行研究の結果、① A βはアルツハイマー病に対する疾患特異性が高い、②家族性アルツハイマー病のある種のタイプはA βの前駆体遺伝子に変異を持つ、③ A βが沈着した老人斑が最も初期の病理学的変化である、④ A βが少数重合したオリゴマーは神経毒性が強い、という4 つの知見が明らかにされ、これらは現在、アルツハイマー病の発症に関してもっとも有力な仮説、アミロイドカスケード仮説を支持する重要な根拠となっています(図2)。
アルツハイマー病の根本治療薬の開発に力を入れていきたい
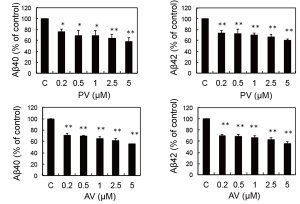
図3:スタチンによるA βの抑制
( PV:ピタバスタチン、AV:アトロバスタチン)
Hosaka A, et al. Neurochem Res, 38: 589-600, 2013.より引用
じつは、A βそのものは、私たちの体の中に大量にあり髄液中にも存在しています。A βが毒性を持つのは、これらが2 個~数百個程度集まったオリゴマーであり、この産生を抑制するためのさまざまな疾患治療薬が開発されています。そのなかで私たちが注目しているのはA βのN末端を切る酵素、β – セクレターゼ(BACE1)の阻害剤です。遺伝子欠損による異常が軽微なBACE1 を標的とすることで、副作用の少ない治療薬の開発できると考えています。BACE1 はA βオリゴマーにより発現の増加が示されており(Mamada N, et al. Mol Brain. 2015 Nov 9;8(1):73.)、BACE1 阻害薬はAD の治療薬として合理的と考えられます。また、A βに対するモノクローナル抗体も早期に投与すれば有効である可能性が示唆されています。現在、筑波大学に新設されたつくば臨床医学研究開発機構(T-CReDO)を中心に、さまざまな国内外の製薬会社と臨床研究を進めており、BACE1 阻害剤や抗A βモノクローナル抗体の治験を進めています。また、医薬品の再開発も重要なテーマと考えており、高コレステロール血症治療薬のスタチンがA β抑制に有効であるという知見を見いだしております(図3)。抗A βモノクローナル抗体の臨床研究では、投与時期・投与量の最適化にも取り組んでいます。これらの研究を通じて、今後もアルツハイマー病の治療法確立に取り組んで行きたいと考えています。
社会への貢献・実績
- アストラゼネカ、メルク、エーザイとの多施設共同治験の実施
取材:平成26年7月16日
Establish treatments for neurodegenerative disorders based on the molecular pathological analysis of abnormal proteins that accumulate in the nervous system
Unit members : Ishii, Akiko Ishii, Kazuhiro Nakamagoe, Kiyotaka Tamiya, Nanako Tomidokoro, Yasushi Masu, Masayuki Keino-Masu, Kazuko
Unit name: Molecular Pathophysiology of Neurodegenerative Disorders
Keywords: Alzheimer’s disease, Parkinson’s disease, multiple system atrophy, amyotrophic lateral sclerosis, frontotemporal lobar degeneration
 Neurodegenerative diseases, such as Alzheimer’s disease, Parkinson’s disease, multiple system atrophy, amyotrophic lateral sclerosis, and frontotemporal lobe dementia, are intractable. These diseases are closely associated with aging and characterized by continued neuronal loss for unknown causes. Our research unit “Molecular Pathophysiology of Neurodegenerative Disorders” has investigated the molecular pathogenesis of abnormal protein accumulation in the nervous system in neurodegenerative diseases to facilitate the analyses of pathogenic substances and develop treatments for neurodegenerative diseases (Figure 1).
Neurodegenerative diseases, such as Alzheimer’s disease, Parkinson’s disease, multiple system atrophy, amyotrophic lateral sclerosis, and frontotemporal lobe dementia, are intractable. These diseases are closely associated with aging and characterized by continued neuronal loss for unknown causes. Our research unit “Molecular Pathophysiology of Neurodegenerative Disorders” has investigated the molecular pathogenesis of abnormal protein accumulation in the nervous system in neurodegenerative diseases to facilitate the analyses of pathogenic substances and develop treatments for neurodegenerative diseases (Figure 1).
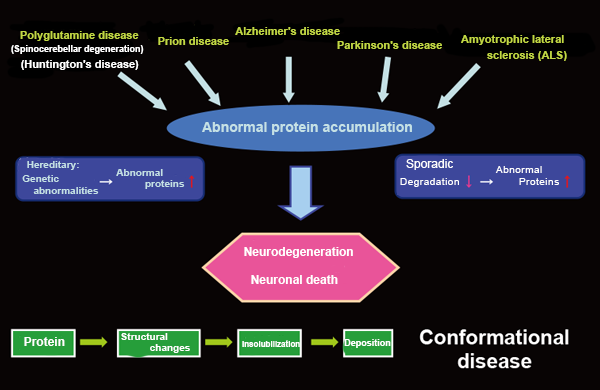
Figure 1: Molecular pathogenesis of neurodegenerative diseases
Important evidence to support the amyloid cascade hypothesis
Polyglutamine, prion, Alzheimer’s, and Parkinson’s diseases and amyotrophic lateral sclerosis (ALS) are characterized by continued neuronal loss for unknown causes. All these diseases are characterized by abnormal protein deposition in the nervous system. The deposition has been investigated all over the world, revealing that it is caused by abnormal protein structures and degradation. Particularly, we have investigated amyloid β protein (Aβ). Deposition of Aβ is observed at the earliest stage in the development of Alzheimer’s disease from which 4 million patients are suffered in Japan. Previous studies on Aβ have revealed that (1) Aβ shows high specificity to Alzheimer’s disease, (2) mutations are detected in the precursor gene of Aβ in certain types of familial Alzheimer’s disease, (3) senile plaques with Aβ deposition is the earliest pathological change, and (4) oligomers with a small number of Aβ polymerized are strongly neurotoxic. These findings provide evidence to support the amyloid cascade hypothesis, a leading hypothesis for the cause of Alzheimer’s disease (Figure 2).
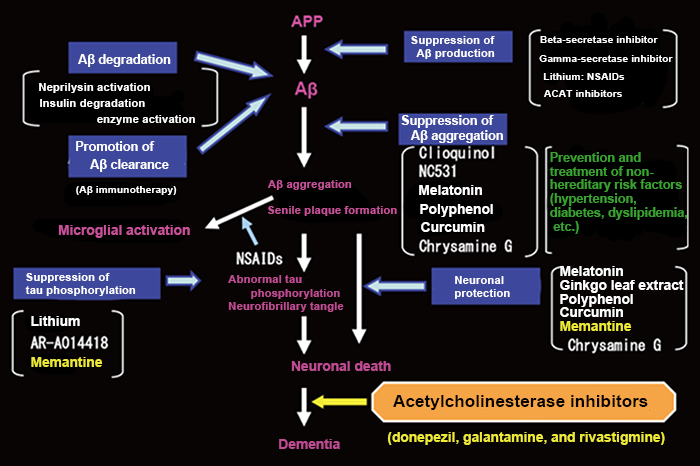
Figure 2: Amyloid cascade hypothesis and treatment strategy for Alzheimer’s disease
Development of basic remedies for Alzheimer’s disease (AD)

Figure 3: Suppression of Aβ with statins (PV: pitavastatin, AV: atorvastatin). Hosaka A, et al., Neurochem Res, 38: 589-600, 2013.
In the human body, a large amount of Aβ exists in the cerebrospinal fluid. What toxic are Aβ oligomers with two to several hundreds of Aβ polymerized, and various therapeutic agents have been developed to suppress their production. Of such agents, we are investigating a β-secretase (BACE1) inhibitor, which cleaves the N-terminus of Aβ. Targeting the BACE1 gene with minor genetic defects may lead to the development of therapeutic agents with few adverse effects. Since the expression of BACE1 is increased by Aβ oligomers (Mamada N, et al., Mol Brain 2015 Nov 9; 8(1): 73), BACE1 inhibitors should serve as therapeutic agents for AD. In addition, it has been suggested that anti-Aβ monoclonal antibodies are effective for AD when administered at an early stage. At Tsukuba Clinical Research & Development Organization (T-CReDO), newly established in the University of Tsukuba, clinical trials are underway on BACE1 inhibitors and anti-Aβ monoclonal antibodies in collaboration with pharmaceutical companies in Japan and foreign countries. Also, the redevelopment of drugs is our important theme. We have demonstrated that statin, a therapeutic agent for hypercholesterolemia, effectively inhibited Aβ (Figure 3). In the clinical trial of anti-Aβ monoclonal antibodies, the timing and dose of administration are being optimized. Thus, we will be committed to the establishment of treatment for AD.
Social contributions and achievements
- Multi-center clinical trial in collaboration with AstraZeneca, Merck, and Eisai
Interviewed on July 16, 2014
